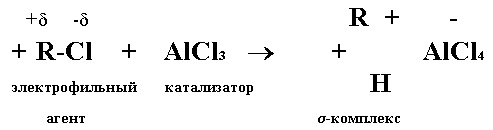
Замещенные ароматические сульфоны и их производные являются промежуточными продуктами в синтезе термостойких полимерных материалов, красителей, а также фармацевтических препаратов. Основным классом полимеров, получаемых на основе ароматических сульфонов, являются полисульфоны, которые представляют собой термопластичные полимеры, обладающие повышенной термостойкостью, самозатухаемостью и высокой гидролитической устойчивостью в присутствии сильных кислот и оснований. Они устойчивы к радиационному облучению, нетоксичны и могут работать в температурном интервале от 100 до 250њ С.
Свойства полисульфонов, во многом, определяются наличием сульфоновой группы, устойчивой к окислению. Это обусловлено высшей степенью окисления атома серы, а также способностью сульфогруппы оттягивать электроны соседних бензольных ядер, что ведет к повышению их устойчивости.
Исследования, проводимые в Ярославском Государственном Техническом Университете, показали, что, используя замещенные диарилсульфоны, можно ввести дифенилсульфоновые мостики в такие классы полимеров, как полиамиды, поликарбонаты, полиэфиры, которые приобретают некоторые свойства полисульфонов: термостойкость, огнестойкость, устойчивость к действию кислот и хорошую перерабатываемость.
Целью настоящей работы является изучение методов синтеза 3,4-диметил-4'-хлордифенилсульфона, который представляет интерес как перспективное исходное соединение для получения термостойких полимерных материалов. Наличие в молекуле этого сульфона двух метильных групп и атома хлора дает возможность путем различных химических превращений получать на его основе ди- и тетракарбоновые кислоты, ангидриды и на их основе синтезировать полиэфиры, поликарбонаты и другие полимеры, содержащие дифенилсульфоновые группировки. Работа выполнена в плане продолжения исследований, проводимых Проблемной лабораторией Ярославского Государственного Технического Университета.
Для синтеза 3,4-диметил-4'-хлордифенилсульфона может быть применена реакция Фриделя - Крафтса. Эта реакция широко известна в органической химии и применяется для алкилирования и ацетилирования бензола и его гомологов, для получения ароматических кетонов, замещенных бензола, антрацена и других веществ. Она протекает по механизму электрофильного замещения в присутствии катализаторов. В качестве катализатора обычно используется хлористый алюминий AlCl3,а также ZnCl2, FeCl3, SbCl5 и другие.
Реакция электрофильного замещения в ароматическом ядре проходит в две стадии: первая стадия заключается в образовании промежуточного s-комплекса;
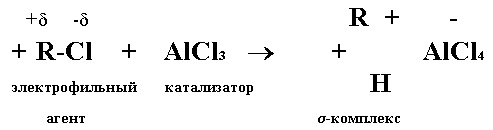
Второй стадией является переход s-комплекса в продукт реакции с выделением протона.
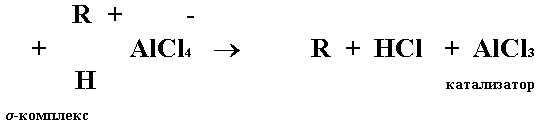
Интерес к использованию реакции Фриделя-Крафтса для синтеза 3,4-диметил-4'-хлордифенилсульфона обусловлен доступностью веществ, которые могут быть использованы для его получения: хлорбензол и 1,2-диметилбензол (о-ксилол) производятся промышленностью в значительном объеме, а методы получения сульфохлоридов разработаны в Проблемной лаборатории ЯГТУ.
Возможны два пути синтеза 3,4-диметил-4'-хлордифенилсульфона по реакции Фриделя-Крафтса. Первый заключается в конденсации 4-хлорбензолсульфохлорида с 1,2-диметилбензолом:
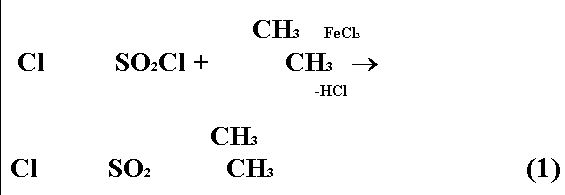
Второй основан на реакции между 3,4-диметилбензолсульфохлоридом и хлорбензолом:
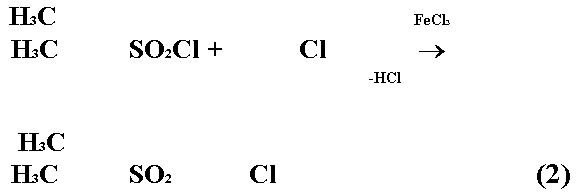
В качестве катализатора нами использовался безводный хлорид железа, так как проведенные ранее исследования по синтезу диарилсульфонов показали нецелесообразность применения хлорида алюминия. Это связано с тем, что образующийся сульфон связывает катализатор AlCl3 в неактивный продукт присоединения и поэтому необходимо брать большой избыток хлорида алюминия: не менее 1 моль на 1 моль получаемого сульфона. Хлорное железо может применяться в реакции сульфонилирования в каталитических количествах. В этом случае также наблюдалось образование комплексов катализатора FeCl3 с продуктом реакции, однако эти комплексы менее устойчивы и легко распадаются с регенерацией катализатора.
Синтез 3,4-диметил-4'-хлордифенилсульфона осуществлялся по следующей методике: в трехгорлую колбу с мешалкой, термометром и холодильником загружали 3,4-диметилбензосульфохлорид, хлорбензол и 1 масс.% безводного хлорного железа, являющегося катализатором реакции. Реакционную массу нагревали на силиконовой бане до 130 - 135 њС и перемешивали при этой температуре 10 часов до прекращения выделения хлористого водорода через холодильник. Охлажденную реакционную массу выливали в воду, выпавший в осадок сульфон отфильтровывали, промывали водой до нейтральной среды и высушивали.
По аналогичной методике из 4-хлорбензолсульфохлорида и 1,2-диметилбензола ( о-ксилола ) в присутствии 1 масс.% безводного хлорного железа тоже получали диметилхлордифенилсульфон.
По обеим реакциям в одинаковых условиях получается целевой сульфон с выходом около 96 мол.%. Продукты реакции (1) и (2) анализировали методами ИК-спектроскопии и газожидкостной хроматографии. Инфракрасные спектры получены на двухлучевом спектрофотометре "Спектромом 2000". Сульфоны анализировали в виде суспензии в вазелиновом масле. Хроматограммы получены на хроматографе "Цвет 2" с пламенно-ионизационным детектором, газ-носитель - азот, скорость подачи 30 мл/мин. Колонка стеклянная 300Х3мм, температура 225-235њС, стационарная фаза - 1% неопентилгликольсукцинат на "Chromoton W", растворитель анализируемых сульфонов - ацетон.
Хроматограмма и ИК-спектр продуктов, полученных по реакции (1) представлены на рисунке 1. Хроматограмма показывает, что полученный сульфон состоит из двух изомеров: 1-ый - 3,4-диметил-4'-хлордифенилсульфон, 2-ой - 2,3- диметил-4'-хлордифенилсульфон. Содержание изомеров составляет 65% и 35% соответственно. Обсчет хроматограммы производился путем суммирования площадей пиков. На ИК-спектре видны деформационные колебания С-Н связей в 1,2,4-тризамещенных бензола (900 см*) и в 1,2,3-тризамещенных бензола (810 см*), что подтверждает наличие двух изомеров целевого сульфона. Разделить изомеры, полученные по реакции (1) не удается ни вакуумной перегонкой, ни двукратной кристаллизацией из ацетона и спиртов (этанола, пропанола-1, пропанола-2).
По реакции (2) образуется чистый в изомерном отношении 3,4-диметил-4'-хлордифенилсульфон, хроматограмма и ИК-спектр которого представлены на рисунке 2. Для использования в дальнейших синтезах сульфон, полученный по реакции (2), тщательно очищался от катализатора - хлористого железа. Для этого использовалась перегонка сульфона в вакууме или перекристаллизация из спиртов (этанола, пропанола-1, пропанола-2) или ацетона. Температура плавления чистого, 3,4-диметил-4'-хлордифенилсульфона 101-102њС (из этанола).
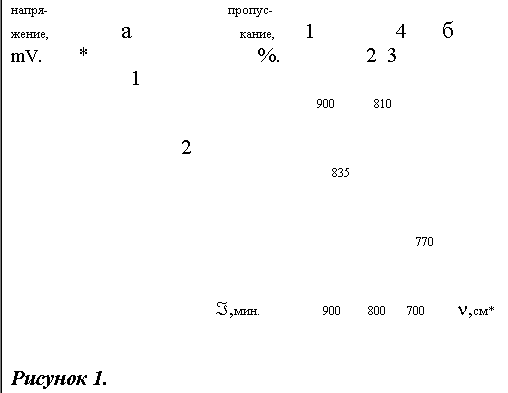
Хроматограмма (а) и ИК-спектр (б) диметилхлордифенилсульфона,полученного по реакции 1.
Хроматограмма:1 3,4-диметил-4'-хлордифенил- сульфон, 2 2,3-диметил-4'-хлордифенил- сульфон, *-растворитель.
ИК-спектр: 1 - деформационные колебания С-Н связей в 1,2,4-тризамещенных бензола (900-860, 860-800 см*), 2 - деформационные колебания С-Н связей в 1,4-дизамещенных бензола (860-800 см*), 3 - деформационные колебания С-Н связей в 1,2,3-тризамещенных бензола (810-770 см*), 4 - валентные колебания связи С-С1 (800-700 см*).
*- -1 степень.
В скобках указаны литературные данные (8,9).
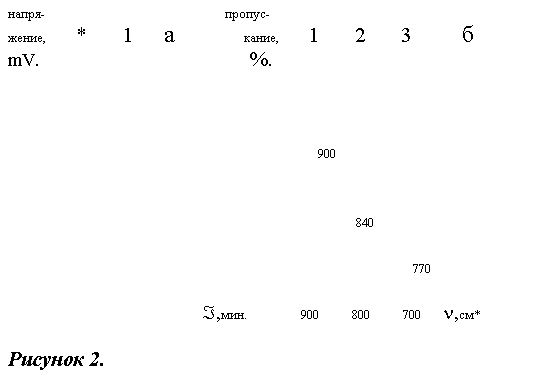
Хроматограмма (а) и ИК-спектр (б) 3,4- диметил4'-хлордифенилсульфона, полученного по реакции 2.
Хроматограмма:1 3,4-диметил-4'-хлордифенил- сульфон, *-растворитель.
ИК-спектр: 1 - деформационные колебания С-Н связей в 1,2,4-тризамещенных бензола (900-860, 860-800 см*), 2 - деформационные колебания С-Н связей в 1,4-дизамещенных бензола (860-800 см*), 3 - валентные колебания связи С-С1 (800-700 см*).
*- -1 степень.
В скобках указаны литературные данные (8,9).
1.Изучены два варианта синтеза 3,4-диметил-4'-хлордифенилсульфона по реакции Фриделя - Крафтса.
2.Практический интерес представляет второй путь, основанный на взаимодействии 3,4-диметил-бензолсульфохлорида и хлорбензола (реакция 2), который дает возможность получать чистый в изомерном отношении сульфон с высоким выходом.
3.Однородный изомерный состав 3,4-диметил-4'-хлордифенилсульфона открывает широкие перспективы для использования его в синтезе многоядерных карбоновых кислот, содержащих фенокси- , окси- , и тиофенильные группы.
© ярославский областной Центр Дистанционного Обучения школьников, 1999