| Вернуться на главную страницу |
|
Автор доклада: Савватеев Павел школа № 37 , 11б класс. Научный руководитель: ст. научный сотрудник ЯГТУ, кандидат химических наук Герасимова Н.П. |
Замещенные ароматические сульфоны и их производные являются промежуточными продуктами в синтезе термостойких полимерных материалов, красителей, а также фармацевтических препаратов. Основным классом полимеров, получаемых на основе ароматических сульфонов, являются полисульфоны, которые представляют собой термопластичные полимеры, обладающие повышенной термостойкостью, самозатухаемостью и высокой гидролитической устойчивостью в присутствии сильных кислот и оснований. Они устойчивы к радиационному облучению, нетоксичны и могут работать в температурном интервале от 100 до 250° С.
Свойства полисульфонов, во многом, определяются наличием сульфоновой группы, устойчивой к окислению. Это обусловлено высшей степенью окисления атома серы, а также способностью сульфогруппы оттягивать электроны соседних бензольных ядер, что ведет к повышению их устойчивости.
Исследования, проводимые в Ярославском Государственном Техническом Университете, показали, что, используя замещенные диарилсульфоны, можно ввести дифенилсульфоновые мостики в такие классы полимеров, как полиамиды, поликарбонаты, полиэфиры, которые приобретают некоторые свойства полисульфонов: термостойкость, огнестойкость, устойчивость к действию кислот и хорошую перерабатываемость.
Целью настоящей работы является изучение методов синтеза 3,4-диметил-4'-хлордифенилсульфона, который представляет интерес как перспективное исходное соединение для получения термостойких полимерных материалов. Наличие в молекуле этого сульфона двух метильных групп и атома хлора дает возможность путем различных химических превращений получать на его основе ди- и тетракарбоновые кислоты, ангидриды и на их основе синтезировать полиэфиры, поликарбонаты и другие полимеры, содержащие дифенилсульфоновые группировки. Работа выполнена в плане продолжения исследований, проводимых Проблемной лабораторией Ярославского Государственного Технического Университета.
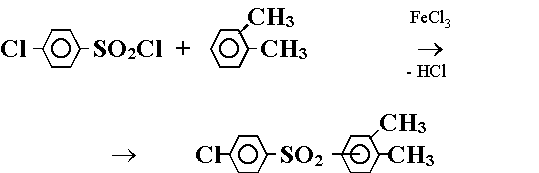
Для синтеза 3,4-диметил-4'-хлордифенилсульфона ранее нами была применена реакция Фриделя - Крафтса и показано, что по этой реакции может быть получен 3,4-диметил-4'-хлордифенилсульфон двумя путями.
Первый заключался в конденсации 4-хлорбензолсульфохлорида с 1,2-диметилбензолом:
(Реакция 1.)

Второй основан на реакции между 3,4-диметилбензолсульфохлоридом и хлорбензолом:
(Реакция 2.)
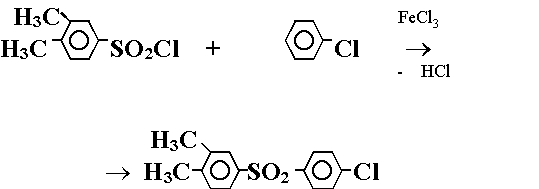
По обеим реакциям в одинаковых условиях был получен целевой сульфон с выходом около 96 мол. %. Анализ продуктов реакций (1) и (2) методами газожидкостной хроматографии и ИК-спектроскопии показал, что только по реакции (2) может быть получен чистый в изомерном отношении 3,4-диметил-4'-хлордифенилсульфон. Этот путь синтеза представляет практический интерес. Однако сульфон, полученный таким способом, трудно очистить от следов катализатора хлорида железа (III), поэтому его невозможно использовать для синтеза полимеров оптического назначения. Поэтому в данной работе нами был изучен другой способ синтеза 3,4-диметил-4'-хлордифенилсульфона, основанный на использовании жидкого серного ангидрида, самого сильного сульфирующего и сульфонилирующего агента. Применение серного ангидрида позволяет проводить реакцию при умеренных температурах, без катализаторов, в течение непродолжительного времени.
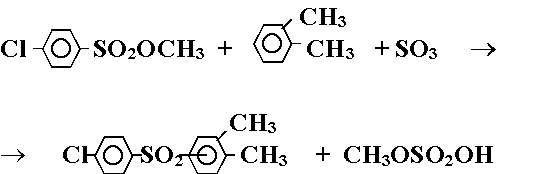
Согласно имеющимся в литературе сведениям, ароматические сульфоны могут быть получены при последовательном взаимодействии алкиловых эфиров арилсульфокислот с жидким серным ангидридом и ароматическими углеводородами. Нами исследованы два варианта синтеза 3,4-диметил-4'-хлордифенилсульфона из алкиловых эфиров арилсульфокислот. В первом использовали метиловый эфир 4-хлорбензолсульфокислоты, серный ангидрид и 1,2-диметилбензол (о-ксилол). Процесс в общем виде может быть представлен реакцией:
(Реакция 3.)
Во втором варианте использовали метиловый эфир 3,4-диметилбензолсульфокислоты, серный ангидрид и хлорбензол:
(Реакция 4.)
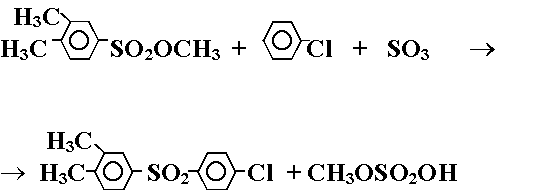
Реакция осуществлялась в две последовательные стадии. Сначала к метиловому эфиру соответствующей сульфокислоты при температуре 30°С в течение 15 минут прибавляли при непрерывном перемешивании стехиометрическое количество свежеперегнанного серного ангидрида и выдерживали полученную смесь при этих условиях в течение одного часа (первая стадия). Затем прибавляли стехиометрическое количество углеводорода и проводили реакцию при 60°С в течение 3-х часов (вторая стадия).
Продукты реакций (3) и (4) анализировали методами ИК-спектроскопии и газожидкостной хроматографии. Инфракрасные спектры получены на двухлучевом спектрофотометре "Спектромом 2000". Сульфоны анализировали в виде суспензии в вазелиновом масле. Хроматограммы получены на хроматографе "Цвет 2" с пламенно-ионизационным детектором, газ-носитель - азот, скорость подачи 30 мл/мин. Колонка стеклянная 300ґ3мм, температура 225-235°С, стационарная фаза - 1% неопентилгликольсукцинат на "Chromoton W", растворитель анализируемых сульфонов - ацетон.
Хроматограмма и ИК-спектр продуктов, полученных по реакциям (3) и (4) представлены на рисунках 1 и 2.
По реакции (3) (рис.1) образуются два изомера ДМХДФС с выходом 60 мол.%, соотношение 3,4-диметил-4'-хлордифенилсульфона и 2,3-диметил-4'-хлордифенилсульфона 2:1. В качестве побочного продукта в этой реакции образуется сульфон симметричного строения - 3,4,3',4'-тетраметилдифенилсульфон с выходом 36 мол.%. На ИК-спектре (рис.1) видны деформационные колебания С-Н связей в 1,2,4-тризамещенных бензола (900 см-1) и в 1,2,3-тризамещенных бензола (810 см-1), что подтверждает наличие двух изомеров целевого сульфона. Разделить изомеры, полученные по реакции (3), не удается ни вакуумной перегонкой, ни двукратной кристаллизацией из ацетона и спиртов (этанола, пропанола-1, пропанола-2).
По реакции (4) образуется чистый в изомерном отношении 3,4-диметил-4'-хлордифенилсульфон с выходом 72 мол.%, хроматограмма и ИК-спектр которого представлены на рисунке 2. Для использования в дальнейших синтезах сульфон, полученный по реакции (4), промывали водой, отфильтровывали и высушивали в вакууме. Использование этого способа синтеза не требует перекристаллизации полученного сульфона, так как он не содержит катализатора, а побочные продукты хорошо растворимы в воде и легко отмываются. Температура плавления чистого 3,4-диметил-4-хлордифенилсульфона 101,4-101,6° С.
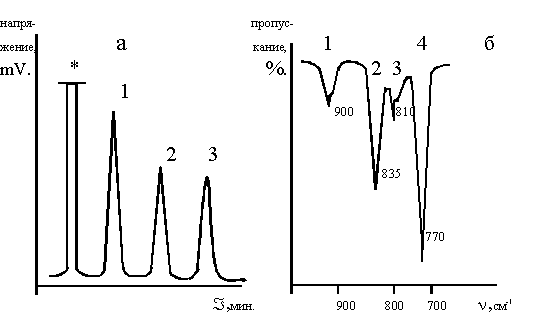
Рисунок 1.
Хроматограмма (а) и ИК-спектр (б) диметилхлордифенилсульфона,полученного по реакции 1.
Хроматограмма: 1 3,4-диметил-4'-хлордифенил- сульфон, 2 2,3-диметил-4'-хлордифенил- сульфон, 3 3,4,3',4'-тетраметилдифенилсульфон
*- растворитель.
ИК-спектр: 1 - деформационные колебания С-Н связей в 1,2,4-тризамещенных бензола (900-860, 860-800 см-1), 2 - деформационные колебания С-Н связей в 1,4-дизамещенных бензола (860-800 см-1), 3 - деформационные колебания С-Н связей в 1,2,3-тризамещенных бензола (810-770 см-1), 4 - валентные колебания связи С-С1 (800-700 см-1)
В скобках указаны литературные данные (8,9).
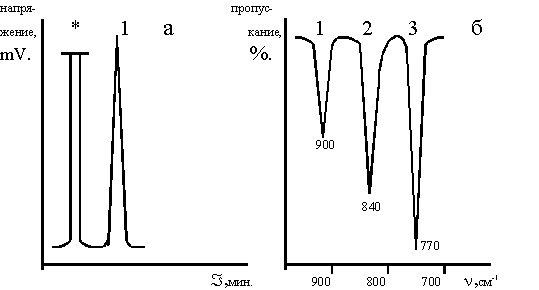
Рисунок 2.
Хроматограмма (а) и ИК-спектр (б) 3,4- диметил-4'-хлордифенилсульфона, полученного по реакции 2.
Хроматограмма: 1 3,4-диметил-4'-хлордифенил- сульфон, *-растворитель.
ИК-спектр: 1 - деформационные колебания С-Н связей в 1,2,4-тризамещенных бензола (900-860, 860-800 см-1), 2 - деформационные колебания С-Н связей в 1,4-дизамещенных бензола (860-800 см-1), 3 - валентные колебания связи С-С1 (800-700 см-1).
В скобках указаны литературные данные (8,9).
| Вернуться на главную страницу |